Cologne, Germany
December 4, 2020
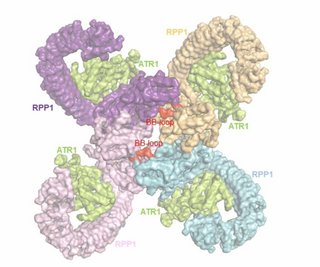
Figure 1 The RPP1 resistosome: a top view of the cryo-EM structure Tetrameric assembly of the RPP1 resistosome shown from the surface. The four RPP1 monomers are labeled and shown in different colors: ATR1 is shown in green; BB-loops that mediate formation of the asymmetric RPP1 TIR dimers are labeled and shown in red.
Research team from the University of Cologne and the Max Planck Institute for Plant Breeding Research (MPIPZ) explore the activation of plant immune receptors by pathogens /similar function of immune receptors in plants and animals
In a recent study, Alexander von Humboldt Professor Jijie Chai at the University of Cologne and his team together with MPIPZ researchers have succeeded for the first time in reconstructing the sequence of molecular events that activate an inactive plant immune receptor and thus mediate the death of the host cell. The researchers’ discoveries are of great importance for understanding how these critical plant immune molecules protect their hosts from infections. The configuration adopted by the activated protein is similar to that of other plant and mammal receptors, including humans. This suggests that these receptors are based on a common structural principle to trigger intracellular immune signals and cell death in different areas of life.
The scientists describe their results in the article ‘Direct pathogen-induced assembly of an NLR immune receptor complex to form a holoenzyme’ in Science.
Although separated by millions of years of evolution, plants and animals have independently developed similar immune strategies to protect themselves against microbial infections. In both kingdoms of life, immune receptors called nucleotide-binding/leucine-rich repeat proteins (NLR proteins) form an important defence layer within cells against pathogen attack. NLRs are complex devices consisting of several modules. These modules recognize the molecules (effectors) of invading microbes. Effectors trigger the immune response of the plant – they activate receptors, resistance and cell death pathways to limit infection. Based on different structural and signalling characteristics, plant NLRs are divided into two main classes: those that contain coiled-coiled (CC) modules (CNL proteins) and those that contain toll/interleukin-1 receptor/resistance (TIR) modules (TNL proteins).
The scientists conducted their research on the model organism Arabidopsis thaliana, or thale cress. Jijie Chai, together with the MPIPZ research group leader Jane Parker and MPIPZ dirctor Paul Schulze-Lefert, determined the structural and biochemical features underlying the activation of a specific receptor: the so-called TNL type NLR Receptor of Peronospora parasitica 1 (RPP1). It protects the model plant against infection with the fungus Hyaloperonospora arabidopsidis (Hpa).
To understand how RPP1 protects plants on the molecular level from Hpa infection, the team generated RPP1 protein together with the known Hpa effector ATR1 . The RPP1 receptor activated in this way is an enzyme that breaks down nicotinamide adenine dinucleotide (NAD+), which is important for defence signalling.
By isolating RPP1-ATR1 complexes and subjecting them to cryo electron microscopy, the authors have answered two open questions of NLR biology: first, how direct binding of the effector to the NLR receptor induces the activation of a receptor. Secondly, they determined that the TNL receptor in this case organizes itself as a so-called tetramer, a molecule consisting of four tightly packed receptor molecules. Tetramers belong to the group of oligomeric molecules, which are all structurally made up of similar units. The observed tetramer creates a unique surface within a part of the receptor, which is necessary for the cleavage of NAD+ to trigger defence signals.
The effector ATR1 induces tetramerization at one end of RPP1 and simultaneously forces the above-mentioned four TIR modules at the opposite end of the molecule to form two asymmetric TIR pairs that degrade NAD+.
Strikingly, the results of the groups around Eva Nogales and Brian Staskawicz at the University of California, Berkeley, on another NLR of the TNL type, Roq1 from the tobacco relative Nicotiana benthamiana, also show that TNL activation involves direct effector recognition and adoption of a similar tetrameric structure. The effector recognized by Roq1 is produced by a bacterial pathogen and the activated Roq1 receptor complex provides resistance to bacterial infections. Therefore, the discoveries of Jijie Chai, his team and the MPIPZ researchers seem to be of great importance for understanding how these critical plant immune molecules protect their hosts from infections. More generally, the oligomeric configurations adopted by active RPP1 and Roq1 resemble the induced oligomeric scaffolds of other plant and mammalian NLR receptor proteins, including human innate immune receptors. This suggests that these receptors are based on a common structural principle to trigger intracellular immune signals and cell death in different kingdoms of life.
Funktionsweise pflanzlicher Immunrezeptoren entschlüsselt
Funktionsweise pflanzlicher Immunrezeptoren entschlüsselt
04.12.2020
Forschungsteam der Universität zu Köln und des Max-Planck-Institut für Pflanzenzüchtungsforschung (MPIPZ) untersucht Aktivierung pflanzlicher Immunrezeptoren durch Krankheitserreger / Immunrezeptoren von Pflanzen und Tieren funktionieren ähnlich
In einer aktuellen Studie ist es Alexander von Humboldt-Professor Jijie Chai von der Universität zu Köln und seinem Team gemeinsam mit MPIPZ Forschern erstmals gelungen, die Abfolge der molekularen Ereignisse nachzuvollziehen, die einen inaktiven pflanzlichen Immunrezeptor aktivieren und so den Tod der Wirtszelle vermitteln. Die Entdeckungen der Forscher sind für das Verständnis, wie diese kritischen pflanzlichen Immunmoleküle ihre Wirte vor Infektionen schützen, von großer Bedeutung. Die von den aktivierten Proteinen angenommenen Konfigurationen ähneln denen anderer Pflanzen- und Säugetierrezeptoren, einschließlich des Menschen. Dies legt nahe, dass diese Rezeptoren auf einem gemeinsamen Strukturprinzip beruhen, um intrazelluläre Immunsignale und den Zelltod in verschiedenen Lebensbereichen auszulösen.
Die Wissenschaftler und Wissenschaftlerinnen beschreiben ihre Ergebnisse in dem Artikel „Direct pathogen-induced assembly of an NLR immune receptor complex to form a holoenzyme“ in Science.
Obwohl durch Millionen von Jahren der Evolution getrennt, haben Pflanzen und Tiere unabhängig voneinander ähnliche Immunstrategien entwickelt, um sich gegen mikrobielle Infektionen zu schützen. Bei beiden Reichen bilden Immunrezeptoren, die als Nukleotid-bindende/Leucin-reiche Wiederholungsproteine (NLR-Proteine) bezeichnet werden, eine wichtige Verteidigungsschicht innerhalb der Zellen gegen den Angriff von Krankheitserregern. NLRs sind komplexe Vorrichtungen, die aus mehreren Modulen bestehen. Diese Module erkennen die Moleküle (Effektoren) von eindringenden Mikroben. Effektoren lösen die Immunreaktion der Pflanze aus, sie aktivieren die Rezeptoren, Resistenz und Zelltodwege, um die Infektion zu begrenzen. Basierend auf unterschiedlichen Struktur- und Signalmerkmalen werden pflanzliche NLRs in zwei Hauptklassen eingeteilt: solche, die Coiled-coiled (CC)-Module (CNL-Proteine) enthalten, und solche, die Toll/Interleukin-1-Rezeptor/Resistenz (TIR)-Module (TNL-Proteine) enthalten.
Die Wissenschaftler und Wissenschaftlerinnen führten ihre Forschungen am Modellorganismus Arabidopsis thaliana, der Acker-Schmalwand, durch. Jijie Chai ermittelte gemeinsam mit der MPIPZ Forschungsgruppenleiterin Jane Parker und dem Leiter des MPIPZ, Paul Schulze-Lefert, die strukturellen und biochemischen Merkmale, die der Aktivierung eines bestimmten Rezeptors zugrunde liegen: des sogenannten TNL-Typ NLR Rezeptors von Peronospora parasitica 1 (RPP1). Er schützt die Modellpflanze vor einer Infektion durch den Pilz Hyaloperonospora arabidopsidis (Hpa).
Um auf molekularer Ebene zu verstehen, wie RPP1 Pflanzen vor einer Hpa-Infektion schützt, erzeugte das Team RPP1-Protein zusammen mit einem bekannten Hpa-Effektor-ATR1-Protein. Der auf diese Weise aktivierte RPP1-Rezeptor ist ein Enzym, das Nicotinamid-Adenin-Dinucleotid (NAD+) abbaut, was für die Abwehrsignalwegewichtig ist.
Indem sie RPP1-ATR1-Komplexe isolierten und sie der Kryo-Elektronenmikroskopie unterzogen, haben die Autoren zwei offene Fragen der NLR-Biologie beantwortet: erstens, wie die direkte Bindung des Effektors am NLR-Rezeptor die Aktivierung eines Rezeptors induziert. Zweitens ermittelten sie, dass der TNL-Rezeptor sich in diesem Fall als sogenanntes Tetramer organisiert, ein Molekül, das aus vier dicht gepackten Rezeptormolekülen besteht. Tetramere gehören zu der Gruppe von oligomeren Molekülen, die alle strukturell aus gleichartigen Teilen aufgebaut sind. Das beobachtete Tetramer schafft eine einzigartige Oberfläche innerhalb eines Teils des Rezeptors, die für die Spaltung von NAD+ zur Auslösung von Abwehrsignalen notwendig ist.
Der Effektor ATR1 induziert dabei an einem Ende von RPP1 die Tetramerisierung und zwingt gleichzeitig am entgegengesetzten Ende des Moleküls die oben genannten vier TIR-Module, zwei asymmetrische TIR-Paare zu bilden, die NAD+-abbauen.
Auffallend ist, dass die Ergebnisse aus den Gruppen von Eva Nogales und Brian Staskawicz an der Universität von Kalifornien, Berkeley, zu einem anderen NLR vom TNL-Typ, Roq1 vom Tabak-Verwandten Nicotiana benthamiana, ebenfalls zeigen, dass die TNL-Aktivierung die direkte Effektorerkennung und die Annahme einer ähnlichen tetramerischen Struktur beinhaltet. Der von Roq1 erkannte Effektor wird von einem bakteriellen Pathogen produziert, und der aktivierte Roq1-Rezeptorkomplex sorgt für Resistenz gegen bakterielle Infektionen. Daher scheinen die Entdeckungen von Jijie Chai, seinem Team und der MPIPZ-Forscher von großer Bedeutung für das Verständnis zu sein, wie diese kritischen pflanzlichen Immunmoleküle ihre Wirte vor Infektionen schützen. Allgemeiner gesagt ähneln die oligomeren Konfigurationen, die aktive RPP1 und Roq1 annehmen, den induzierten oligomeren Gerüsten anderer NLR-Rezeptorproteine von Pflanzen und Säugetieren, einschließlich menschlicher Rezeptoren des angeborenen Immunsystems. Dies legt nahe, dass diese Rezeptoren auf einem gemeinsamen Strukturprinzip beruhen, um intrazelluläre Immunsignale und den Zelltod in verschiedenen Reichen des Lebens auszulösen.